蛙病毒(Ranavirus)是一类能跨种感染全球各地变温动物(包括鱼类、两栖类、爬行类等)的核质大DNA病毒(NCLDVs)成员,但其复制和转录机制在较大程度上仍属未知。近日,中国科学院水生生物研究所水生病毒学学科组基于建立高效蛙病毒重组、基因复制及功能测试系统,以及从鱼类细胞新生DNA中分离特定蛋白、重组病毒亲和层析和纳米荧光素酶NanoLuc互补及质谱分析技术,鉴定并揭示了蛙病毒复制和转录机器的组织架构及相关作用机制。
蛙病毒的复制和转录机器是一个由至少30种病毒蛋白和6种宿主蛋白构成的复杂装置;其核心复制体由病毒DNA聚合酶 (vDPOL)、增殖细胞核抗原(vPCNA)、单链DNA结合蛋白(vSSB)、解旋酶/引物酶(vhelicase/primase)等构成;而转录复合物的核心病毒RNA聚合酶则包含宿主RNA聚合酶II(RNAPII)亚单位Rpb3、Rpb6和Rpb11等蛋白;经实验验证蛙病毒复制和转录机器中多种蛋白之间的关联与相互作用(图1)。
其中,转录复合物核心包含宿主聚合酶亚基,这在核质大DNA病毒群【虹彩病毒科(Iridoviridae)、痘病毒科(Poxviridae)、非洲猪瘟病毒科(Asfarviridae)、藻类DNA病毒科(Phycodnaviridae)及拟菌病毒科(Mimiviridae)等】中属首次涉及。研究进一步证实,作为病毒DNA复制和转录的连接体与调节中心,蛙病毒复制体核心蛋白vDPOL可与不同病毒及宿主蛋白相互作用,这预示该机器在蛙病毒跨种感染过程中具有关键作用,为进一步阐释子代蛙病毒的高效复制及跨物种感染机制提供了全新视野。
相关研究成果以Replication and transcription machinery for ranaviruses: components, correlation, and functional architecture(《蛙病毒的复制和转录机器:组件、相关性及功能架构》)为题,在线发表在Cell & Bioscience上。该研究由水生病毒学科组与中科院院士桂建芳团队合作完成。
此外,基于揭示涵盖虹彩病毒、疱疹病毒、弹状病毒、呼肠孤病毒、线头病毒、双RNA病毒、肌尾病毒、短尾病毒等病毒科中数十种水生病毒完整基因组架构及关键基因功能,在水产动物病毒基因组及病毒-宿主相互作用(Zhang & Gui, Science China Life Sciences, 2015, 58(2):156-169)、蛙病毒跨种感染转录组测试分析及其特征(Ke et al, BMC Genomics, 2018, 19:211)(图2)、鱼类呼肠孤病毒量子点单粒示踪及其胞内动力学(Liu et al, Frontiers in Microbiology, 2018, 9:2797)(图3)、水生病毒的多样性/进化贡献/生态作用(Zhang & Gui, Science China Life Sciences, 2018, 61(12):1486-1502)、蛙病毒经同源细胞受体入侵不同水生动物物种细胞(Ke et al, Viruses, 2019, 11(7), pii: E593)及鲫疱疹病毒环指蛋白的结构与功能(Wang et al, Viruses. 2021,13:254)等方面取得进展。
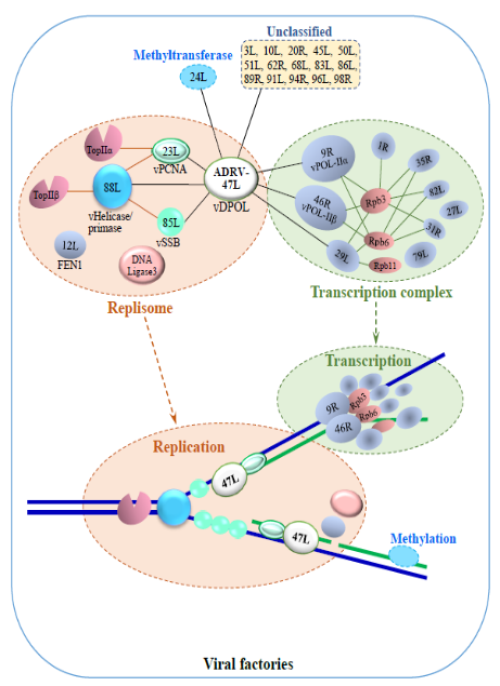
图1蛙病毒转录与复制机器示意图。揭示在病毒加工厂中,这一至少含36种蛋白组分、及各组分在病毒复制与转录过程中行使不同功能与协同作用复杂装置的组成与结构 (Ke et al, Cell & Bioscience, 2022)。

图2跨种感染大鲵的蛙病毒子代及宿主命运示意图。体现跨种感染的蛙病毒进入宿主后,迅速进行扩增,且采取避免过度刺激宿主应答的策略,为子代病毒适应性进化及在不同宿主中跨种传播积蓄力量 (Ke et al, BMC Genomics, 2018)。
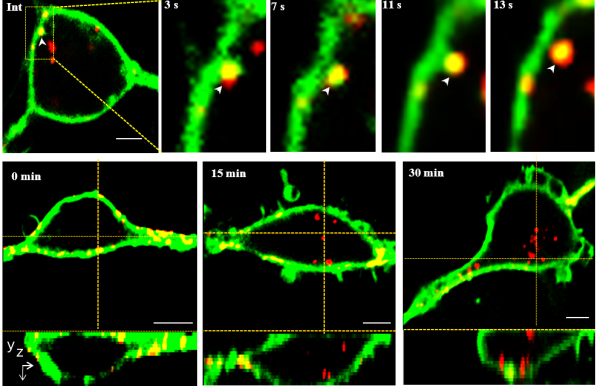
图3量子点示踪的单颗粒鱼类呼肠孤病毒(白色箭头所示)入侵宿主细胞的实时状态图。呈现由量子点标记的单颗粒病毒(红色)侵入细胞膜(绿色)的过程,记录呼肠孤病毒在数秒时间内侵入鱼类细胞的过程 (Liu et al, Frontiers in Microbiology, 2018)。